서론
대뇌 신경 교종은 뇌종양의 약 60%를 차지하는 질환으로 나이와 상관없이 발병되는 질환이다. 다양한 진단 검사 중 18F-FDG PET/CT (18F Fluoro-deoxyglucose Positron Emission Tomography / Computed Tomography)는 암세포의 진단, 병기 결정, 치료반응 모니터링 및 예후 평가에 사용되고 있다[1]. 18F-FDG 섭취가 높을수록 병리학적 등급과 환자 예후에 높은 상관관계가 있다. 그러나 18F-FDG PET/CT의 기능적 종양 영상은 대뇌 신경 교종에 대한 제한점이 존재한다. 정상 대뇌피질의 생리적인 포도당 흡수율이 높아 종양의 대조도가 낮아지게 되어 감별과 등급의 분류에 정확도가 감소한다[2, 3]. 아미노산 표지화합물의 경우 정상 대뇌피질의 섭취가 낮아 종양과 구별이 용이하여 대안검사로 사용하고 있으나, 등급을 분류하는 것에는 어려움이 존재한다[4, 5]. MRI (Magnetic Resoance Imaging)는 진단 검사로 널리 사용하고 있지만, 신경 교종의 등급 정확히 알기 어렵고 종양 주변의 부종을 명확히 구별하는데 한계가 있다[6, 7]. 18F-FDG는 혈당 수치가 110 ㎎/㎗ 이상 올라갈수록 장기와 종양에서의 섭취는 반비례하여 감소한다[8]. 고혈당에서 대뇌피질의 18F-FDG 섭취 감소가 종양과는 다른 양상으로 나타나 뇌종양 검출이 향상되었다는 보고가 있다[9]. 이에 본 논문에서는 혈당을 인위적으로 올리는 포도당 부하 기법(Glucose Loading Method, GLM)을 적용하여 대뇌 신경 교종과 정상 대뇌피질의 대조도를 평가하고자 한다.
실험재료 및 방법
1. 장비 및 대상
장비는 Discovery 710 (GE Healthcare, MI, USA)을 사용하였다(Fig. 1). 영상 재구성은 matrix size 256×256, Gaussian filter 4.0 ㎜, VUE point high-definition (VPHD), 4 iterations, 32 subsets로 하였다. 대상은 당뇨 환자를 제외한 신경 교종 70명으로 하였고 WHO 2016 grading guideline에 따른 병리 결과를 바탕으로 저 등급에서 30명, 고 등급에서 40명으로 분류하였다.
2. 검사 방법
1) 공복 검사(Fasting scan)
최소 6시간 이상 금식한 상태에서 18F-FDG를 5.5 MBq/㎏ 정맥주사 하고 60분이 경과 한 다음 15분간 촬영하였다.
2) 포도당 부하 기법(Glucose loading method, GLM)
최소 6시간 이상 금식한 상태에서 10% DW (Dextrose in Water)를 8 ㎖/min으로 25분간 투여하였다. 이후 18F-FDG를 5.5 MBq/㎏ 정맥주사 하고 60분이 경과 한 다음 15분간 촬영하였다.
3. 분석 방법
종양의 SUVmax를 측정하고 종양 반대편 정상 대뇌피질에 직경 5 ㎝의 관심체적(Volumes of Interest, VOI) 3개를 그려 SUVmean을 측정하였다. 종양 대 정상대뇌피질비(Tumor-to-normal Brain Cortex Ratio, TNR)를 구하여 대조도를 비교 분석하였다. Workstation은 MIMvista software version 6.6.8 (MIM Software Inc., Cleveland, OH, USA)를 사용하였다.
4. 통계 방법
통계분석은 독립표본 t-test를 하였고 버전은 SPSS 20.0을 사용하였다.
결과
1. 통계분석
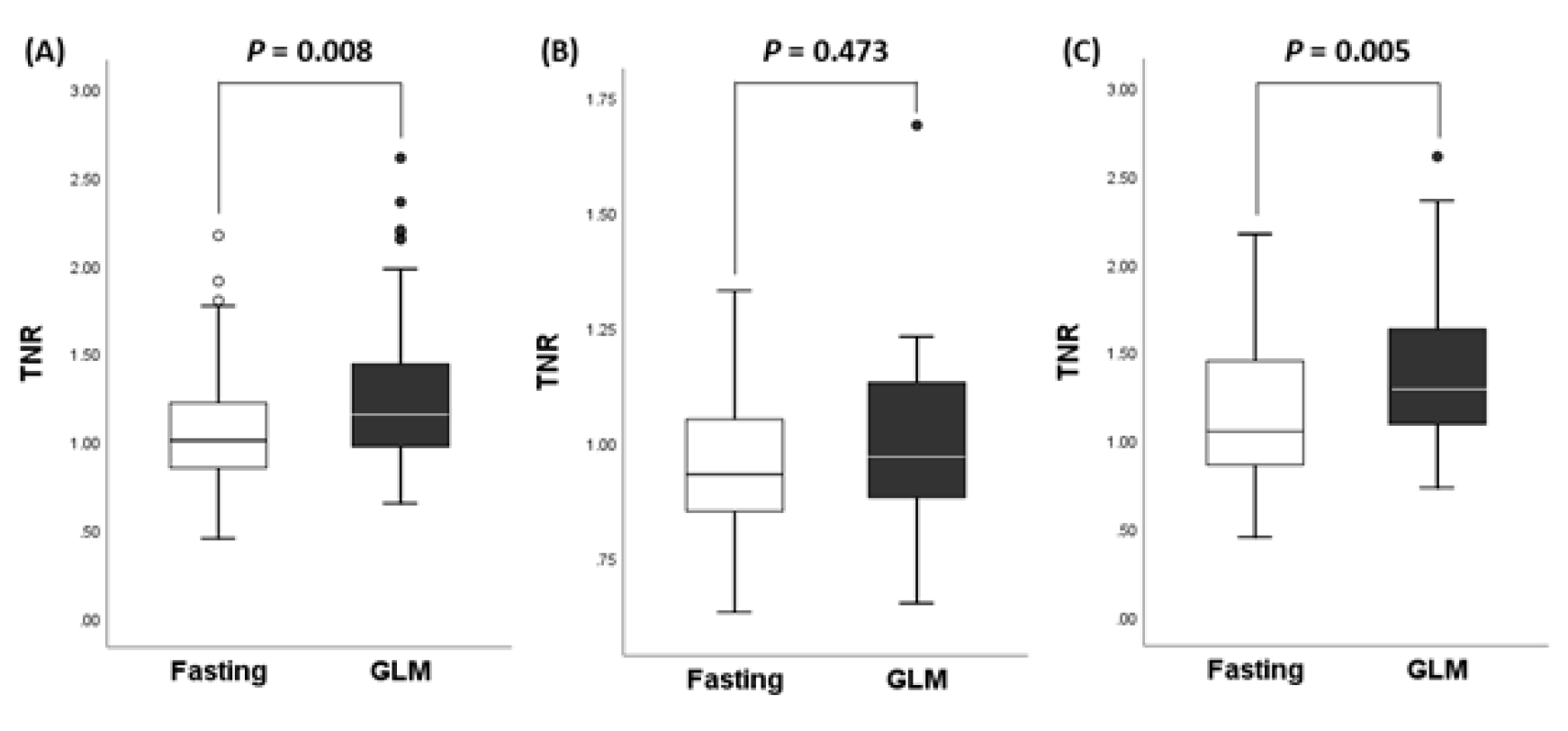
독립표본 t-test결과 Fasting과 GLM에서 통계적으로 유의한 차이가 있었다(P=0.008). 등급을 나눈 통계분석 결과에서는 저 등급과 고 등급에서 확연한 차이가 나타났다(Fig. 2). 저 등급에서 TNR 차이는 4.1%로 유의한 차이가 없었지만(P=0.473), 고 등급에서는 GLM의 TNR이 23% 높았고 통계적으로도 매우 유의한 차이가 있었다(P=0.005)(Table 1).
2. 임상 증례
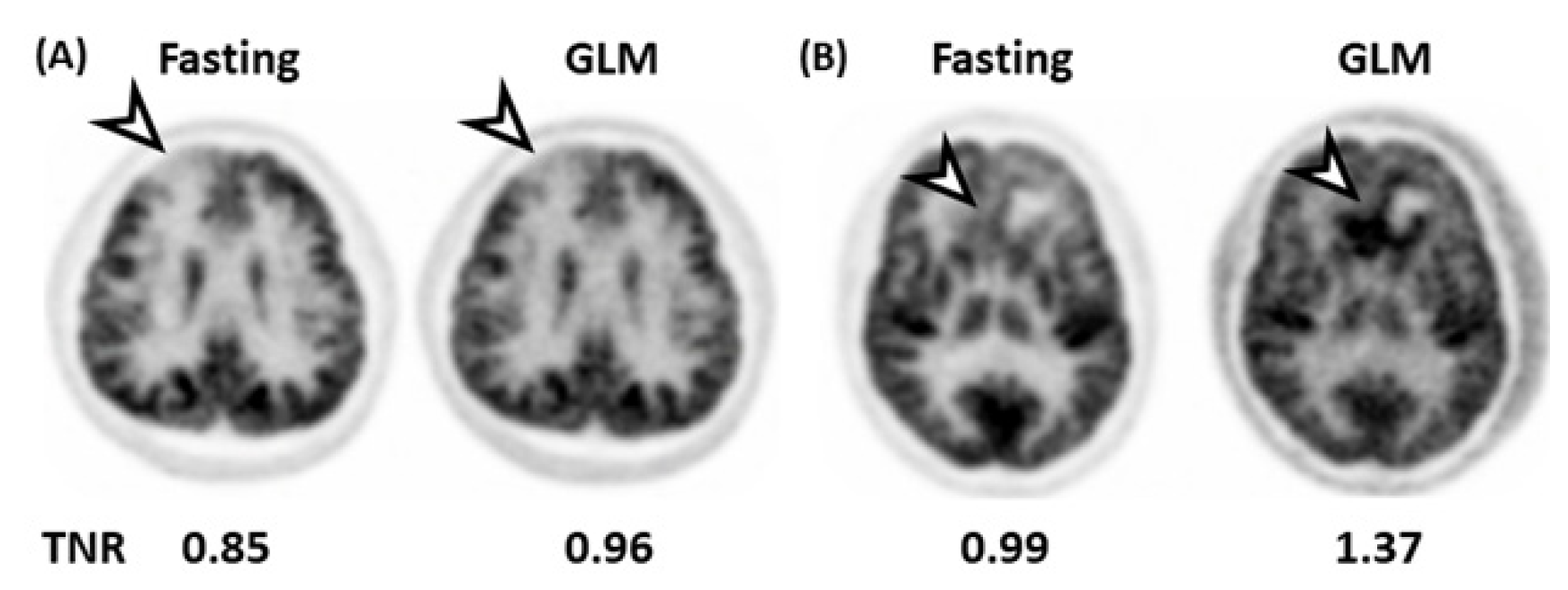
저 등급에서 Fasting과 GLM의 TNR은 대부분 차이가 없었다. 반면 고 등급에서 GLM은 정상 대뇌피질의 섭취 감소양상이 두드려졌고 TNR이 매우 높게 측정되었다(Fig. 3).
고찰
18F-FDG PET/CT에서 혈당이 증가하면 전체적인 뇌의 섭취는 감소한다. 이에 검사 전 전처치로 최소 4시간 이상의 금식이 필요하다[10, 11]. 높은 혈당 수치에서 정상 대뇌피질과 종양의 섭취 감소에는 차이가 존재한다. 본 연구에서는 높은 혈당 수치에서 정상 대뇌피질의 섭취가 종양보다 더욱 감소한다는 것을 발견하였다. 본 임상 환자 연구 시작에 앞서 동물실험을 먼저 진행하였다. 마우스 종양 모델로 정상 대뇌피질과 종양과의 대조도 차이를 확인하기 위해 18F-FDG로 Fasting과 GLM을 영상화하였다. Fasting 영상은 대뇌피질에서 18F-FDG 흡수가 종양에서보다 더 높았다. 이는 대뇌피질이 종양과 섭취 감소 정도가 비슷하거나 더 높음을 시사하는 바이다. 종양에 대한 구분도 명확하지 않았다. 반면, GLM에서는 종양의 명확한 묘사가 있었다. 대뇌피질에서 SUVmax가 종양의 감소(35.9%)보다 더 높은 감소(49.2%)가 나타났으며, 더 높은 TNR을 도출하였다. 마우스 종양 모델은 종양과 정상 피질 사이의 대비를 증가시키는 면에서 GLM의 잠재적인 이점을 보여주었다. 정상 대뇌피질은 다양한 혈당 수준에 영향을 받는다. 최근 보고에 따르면 평균 뇌 SUVmax는 혈당 수치가 110 ㎎/㎗ 이상일 때 점진적으로 감소한다. 대뇌피질의 SUVmax는 혈당 범위가 111–120, 121–140, 141–160, 161–200 및 200 ㎎/㎗ 이상인 경우 각각 20, 35, 50, 60 및 65% 감소하였다[12]. 고혈당 수치가 뇌종양 감지에 미치는 영향을 평가한 보고서로, Ishizu et al. 은 포도당 부하가 뇌종양 검출을 향상시키는 것으로 나타났다[9]. 포도당 부하는 대뇌피질에서 18F-FDG 흡수를 54.2%±13.8% 감소한 반면, 종양에서는 42.5%±15.6% 감소를 나타냈고 TNR은 26.0%±5.7% 증가했다. 이러한 결과는 유용한 정보를 제공할 수 있으나 연구에 포함된 환자 수가 재발성 또는 잔류 신경 교종 환자 8명과 뇌전이 환자 1명으로 적기 때문에 보다 정확한 평가를 위해서는 더 많은 연구군으로 진행해볼 필요가 있다. 본 연구에서 당뇨병 환자는 기준 혈당 수치가 매우 가변적일 수 있으므로 연구군에 포함하지 않았다. 환자의 개별 당뇨병 상태에 따라 포도당 부하 방법을 개인화하여야 하고 과도한 고혈당을 제어하기 위한 추가적인 연구가 필요한 상황이다. 환자의 예후와 관련된 대사성 종양의 부피는 측정하지 않았지만, 고 등급 종양의 정상 대뇌피질의 섭취가 낮았기 때문에 종양 가장자리의 묘사가 쉬웠다. 18F-FDG PET/CT에서 GLM이 고 등급 대뇌 신경 교종의 절제면과 대사성 종양 부피를 더 쉽게 측정할 수 있는지에 대한 연구도 필요할 것으로 생각된다. GLM의 경우 고 등급에서 TNR이 우수하여 종양 감별에 유용하지만 적용하는데 시간이 소요되고 영상의 질을 떨어뜨릴 수 있다. 혈당이 올라가는 것으로 인한 섭취 감소는 결국 신호 대 잡음비(Signal-to-noise Ratio, SNR)를 떨어뜨리는 결과를 초래하였다. 그러나 신경 교종 환자의 18F-FDG PET/CT는 종양에 대한 감별이 매우 중요하므로 SNR보다 TNR이 더 중요하게 여겨진다. 영상의 질 저하 방지를 위해서라도 SNR 개선을 위한 연구가 필요할 것으로 사료된다.